«La notevole capacità della pelle umana di ripararsi da sola le permette di funzionare da barriera protettiva nonostante i danni a cui è soggetta nella sua attività sensoriale dell’ambiente esterno»; con questa frase si apre un articolo pubblicato su Nature Nanotechnology di questo novembre.
Un grosso problema nella costruzione di quelli che vengono volgarmente chiamati “robot” è la difficoltà di controllare la forza con cui le loro “mani” stringono gli oggetti per afferrarli: il procedimento umano è basato un continuo controllo della forza attraverso la sensazione di pressione della mano ma ancora non è possibile simulare adeguatamente questa sensazione e trasformarla in segnali elettrici da elaborare.
Nell’articolo citato, Zhenan Bao e il suo gruppo di ricerca presentano un nuovo materiale dalle straordinari capacità di cambiare le sue proprietà elettriche con l’applicazione di pressioni, anche molto piccole, oppure con piegamento. Per di più questo materiale se danneggiato meccanicamente, ad esempio addirittura tagliato in due pezzi, è in grado, dopo pochi secondi, di colmare la frattura e riprendere le proprietà suddette semplicemente accostando le due parti e premendo leggermente per migliorare il contatto.
La chimica è sempre stata la scienza che studia come gli atomi si legano tra loro per formare molecole: le forze in gioco sono piuttosto elevate, per esempio nella combustione i legami chimici delle molecole si rompono per formare composti più stabili con l’ossigeno producendo calore; per la legna da ardere il calore prodotto si aggira attorno ai 18.000 – 20.000 kJ per chilo. Ma in un materiale sono le forze tra molecola e molecola, molto più deboli di quelle di legame, a determinarne le caratteristiche: nell’esempio della legna, quando si sega si lavora per vincere le forze intermolecolari separando le molecole e non spezzandole. Si può, molto grossolanamente, stimare che le energie in gioco siano da qualche centinaio di kJ per chilo a circa un migliaio. Queste forze sono responsabili del modo in cui le molecole si aggregano tra loro dando luogo ai diversi materiali: dalla “banale” plastica alle strutture biologiche.
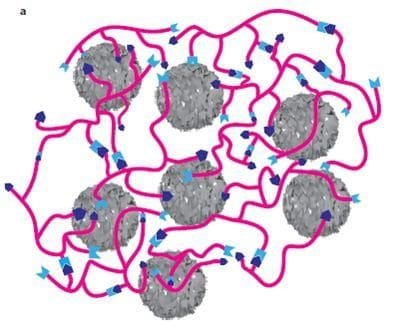
I chimici hanno da tempo esteso lo studio al controllo di tali forze, in modo da progettare materiali con le caratteristiche desiderate: è la cosiddetta chimica supramolecolare. Il materiale in questione è un composito formato da un polimero le cui catene sono legate tra loro da speciali forze intermolecolari, dette legami di idrogeno; disperse nella matrice polimerica ci sono della nano-particelle di nichel anch’esse legate al polimero da legami di idrogeno. Sono proprio queste particelle metalliche a conferire al materiale la conducibilità elettrica: applicando una pressione o deformando il materiale, la distanza tra le particelle cambia e di conseguenza aumenta o diminuisce la capacita di trasferire elettroni da una particella all’altra e quindi la conducibilità l’elettrica.
La proprietà di ripararsi da solo è data anch’essa dai legami d’idrogeno: il taglio del materiale in due parti ha necessariamente rotto un certo numero di legami che, una volta messe a contatto le due superfici, si riformano spontaneamente.
Sono proprio queste particelle metalliche a conferire al materiale la conducibilità elettrica: applicando una pressione o deformando il materiale, la distanza tra le particelle cambia e di conseguenza aumenta o diminuisce la capacita di trasferire elettroni da una particella all’altra e quindi la conducibilità l’elettrica.
La proprietà di ripararsi da solo è data anch’essa dai legami d’idrogeno: il taglio del materiale in due parti ha necessariamente rotto un certo numero di legami che, una volta messe a contatto le due superfici, si riformano spontaneamente.